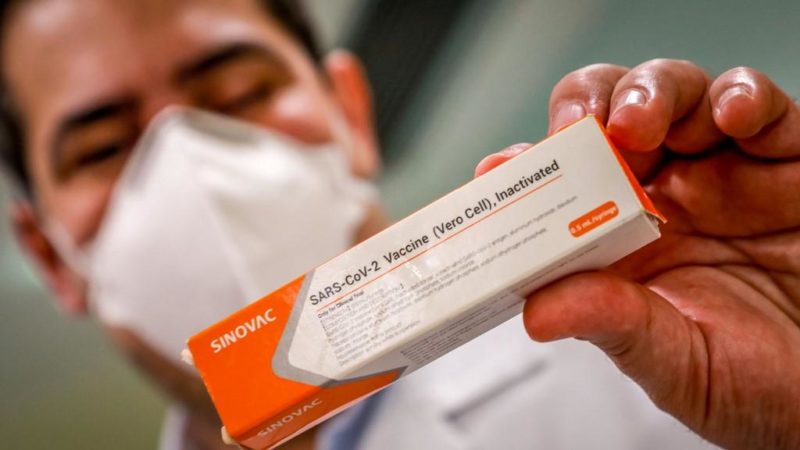
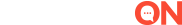ANVISA INTERROMPE ESTUDOS DA CORONAVAC
A Agência Nacional de Vigilância Sanitária (Anvisa) informou nesta segunda-feira que interrompeu os estudos clínicos no país da vacina chinesa contra a Covid-19 da Sinovac, a CoronaVac, após a ocorrência de um evento adverso grave com um dos voluntários.
“O evento ocorrido no dia 29/10 foi comunicado à Anvisa, que decidiu interromper o estudo para avaliar os dados observados até o momento e julgar sobre o risco/benefício da continuidade do estudo”, disse a Anvisa em nota.
Segundo a agência reguladora, a interrupção é prevista pelas normativas da Anvisa e faz parte dos procedimentos de boas práticas clínicas esperadas para estudos clínicos conduzidos no Brasil.
“Com a interrupção do estudo, nenhum novo voluntário poderá ser vacinado”, disse a Anvisa.
O Instituto Butantan, responsável por coordenador o programa de testagem no Brasil e pela produção local da vacina, disse em nota ter sido “surpreendido” com a decisão da Anvisa e indicou não ter conhecimento de qualquer evento adverso entre os participantes do estudo.
“O Butantan informa ainda que está à disposição da agência reguladora brasileira para prestar todos os esclarecimentos necessários referentes a qualquer evento adverso que os estudos clínicos podem ter apresentado até momento”, acrescentou.
Em seu comunicado sobre a interrupção dos testes, a Anvisa não informou se o evento adverso ocorreu no Brasil ou em algum outro país onde a CoronaVac também está sendo testada.
Segundo a Anvisa, os dados sobre voluntários de pesquisas clínicas devem ser mantidos em sigilo, em conformidade com princípios de confidencialidade, dignidade humana e proteção dos participantes.
A agência afirmou que entre os efeitos adveros graves estão morte, risco imediato de morte, incapacidade/invalidez ou doença que exija internação hospitalar, entre outros.
A vacina da Sinovac virou motivo de disputa acirrada entre o presidente Jair Bolsonaro e o governador de São Paulo, João Doria (PSDB), seu desafeto político, uma vez que o Butantan é ligado ao governo paulista.
Bolsonaro vetou um acordo costurado por seu ministro da Saúde, Eduardo Pazuello, que previa a compra de 46 milhões de doses da vacina com o objetivo de integrar o Programa Nacional de Imunização.
O presidente chegou a dizer que a vacina não transmite segurança “pela sua origem” e não tem credibilidade, e se recusou a liberar recursos para o governo de São Paulo investir na produção do imunizante.
No fim do mês passado, o Butantan reclamou de um suposto atraso da Anvisa para aprovar a importação de doses prontas da vacina e de insumos para a fabricação local, o que foi negado pela Anvisa, que posteriormente liberou as importações.
SEGURANÇA
A interrupção dos testes ocorre no mesmo dia em que o governo de São Paulo anunciou o início das obras da fábrica que produzirá a vacina, ao custo de 142 milhões de reais, com expectativa de produzir 100 milhões de doses anuais.
Na ocasião, autoridades estaduais de saúde de São Paulo exaltaram o fato de os ensaios clínicos da CoronaVac não terem registrado qualquer evento adverso até então, e disseram que dados já disponíveis sobre a vacina apontaram sua segurança e que produziu anticorpos contra o coronavírus em quase 98% dos voluntários que a receberam até o momento.
Além da CoronaVac outras três candidatas a vacina estão atualmente em testes no Brasil, incluindo as vacinas em desenvolvimento pelo laboratório AstraZeneca e a Universidade de Oxford e pela Janssen-Cilag, subsidiária da Johnson & Johnson, que também tiveram os testes temporariamente interrompidos no país após a ocorrência de eventos adversos, em ambos os casos em voluntários no exterior.
No mês passado, um voluntário da vacina de Oxford no Rio de Janeiro morreu, mas o ensaio clínico não foi interrompido uma vez que, segundo fontes, ele havia recebido o placebo e não a vacina.
A Sinovac não respondeu de imediato a um pedido de comentário. A CoronaVac está entre três vacinas experimentais contra Covid-19 que a China tem utilizado para inocular centenas de milhares de pessoas sob um programa emergencial, e as autoridades sanitárias do país dizem que não foi observado nenhum efeito adverso grave até o momento.
Por Pedro Fonseca, no Rio de Janeiro, com reportagem adicional de Eduardo Simões, em São Paulo, e Miyoung Kim, em Cingapura
Fonte: Reuters